Investigadores de la Universidad de São Paulo (USP), en Brasil, han descrito la estructura de una enzima importante para el metabolismo del protozoo Leishmania major, causante de leishmaniasis cutánea. Según los autores, los resultados de esta investigación, apoyada por la FAPESP, abren el camino hacia el desarrollo de medicamentos que podrán ser útiles tanto en el tratamiento de los diversos tipos de leishmaniasis, como también en el de la enfermedad de Chagas y el de la enfermedad del sueño (la tripanosomiasis africana).
“La proteína hallada en L. major es muy parecida a la existente en el Trypanossoma cruzi [el causante de la enfermedad de Chagas] y en el T. brucei [causante de la enfermedad del sueño]”, afirma Maria Cristina Nonato, docente de la Facultad de Ciencias Farmacéuticas de Ribeirão Preto (FCFRP-USP), en São Paulo, y coordinadora del estudio. “Por otra parte, es muy diferente a la enzima encontrada en humanos. Esto la convierte en un blanco sumamente interesante para el desarrollo de fármacos”.
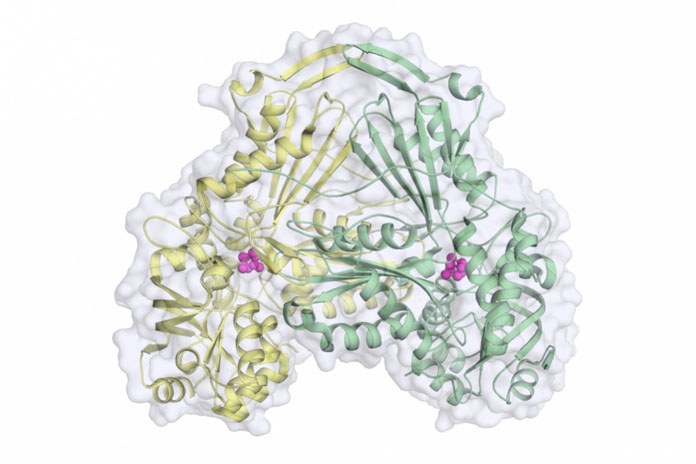
La proteína en cuestión, conocida como fumarato hidratasa, se encarga de catalizar la conversión reversible de malato en fumarato, metabolitos importantes para la supervivencia del parásito, tal y como señalan desde la Agencia Dicyt. En humanos, su deficiencia está relacionada con diversas patologías, tales como la aciduria fumárica, considerada un error innato del metabolismo y caracterizada por la pérdida de tono muscular, un retraso psicomotor y convulsiones, entre otros síntomas. Otros ejemplos son la leiomiomatosis cutánea y uterina (neoplasias benignas de la musculatura lisa) y el carcinoma renal.
En el artículo publicado en la revista Proceedings of the National Academy of Sciences (PNAS), los investigadores han demostrado que, al ovillarse, esta proteína asume un formato tridimensional nunca antes descrito en la literatura científica, que se asemeja a la imagen de un corazón.
También se han identificado durante la investigación los principales residuos de aminoácidos implicados en la reacción catalítica. Este conocimiento, según Nonato, permite desarrollar inhibidores de la actividad enzimática que podrán testearse para evaluar su efecto antiparasitario.